Antimon pentaflorür
Antimon pentaflorür, SbF5 formülüne sahip bir inorganik bileşiktir. Bu kokusuz, viskoz sıvı güçlü bir Lewis asididir ve sıvı HF ile sıvı SbF5'in 1:1 oranında karıştırılmasıyla oluşan süperasit floroantimonik asidin bir bileşenidir. Güçlü lewis asitliği ve neredeyse tüm bilinen bileşiklerle reaksiyona girme yeteneği ile dikkat çekicidir.

| |
| |
| Adlandırmalar | |
|---|---|
antimon(V) florür | |
Diğer adlar antimon pentaflorür pentaflorürantimon | |
| Tanımlayıcılar | |
| ChemSpider | |
| ECHA InfoCard | 100.029.110 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
| UN numarası | 1732 |
CompTox Bilgi Panosu (EPA)
|
|
| Özellikler | |
| Molekül formülü | SbF5 |
| Molekül kütlesi | 216.74 g/mol |
| Görünüm | Renksiz, yağlı sıvı higroskopik |
| Koku | Keskin |
| Yoğunluk | 2,99 g/cm³ |
| Erime noktası | 8,3 °C (281 K) |
| Kaynama noktası | 149,5 °C (422 K) |
| Çözünürlük (su içinde) | Tepki verir |
| Çözünürlük | KF ve sıvı SO2 |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Suyla veya biyolojik dokularla temas ettiğinde hidroflorik asit açığa çıkarır, son derece toksik, oksitleyici, son derece aşındırıcıdır |
| GHS etiketleme sistemi: | |
| Piktogramlar |    
|
| İşaret sözcüğü | Danger |
| Tehlike ifadeleri | H300+H310+H330, H314, H411, H412 |
| Önlem ifadeleri | P260, P261, P264, P270, P271, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P312, P304+P340, P305+P351+P338, P310, P312, P321, P330, P363, P391, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 0.5 mg/m3 (as Sb)[1] |
| REL (tavsiye edilen) | TWA 0.5 mg/m3 (as Sb)[1] |
| Güvenlik bilgi formu (SDS) | ICSC 0220 |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Antimon pentaklorür |
Diğer katyonlar
|
Fosfor pentaflorür Arsenik pentaflorür Bizmut pentaflorür |
Benzeyen bileşikler
|
Antimon triflorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Hazırlanışı
değiştirAntimon pentaflorür, antimon pentaklorür ile susuz hidrojen florürün:[3] tepkimeye girmesiyle hazırlanır
- SbCl5 + 5 HF → SbF5 + 5 HCl
Aynı şekilde antimon triflorür ile flordan da hazırlanabilir.
Yapısı ve kimyasal tepkimeleri
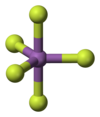
değiştirGaz fazındayken, SbF5, D3h nokta grubu simetrisinin üçgen bipiramidal yapısını benimser. Bu materyal, sıvı ve katı hallerde daha karmaşık yapıları benimser. Her bir Sb'nin oktahedral olduğu polimerler içerir, formül [SbF4(μ-F)2]n (μ-F) ile açıklanan yapı, florür merkezlerinin iki Sb merkezini köprülediği gerçeğini belirtir. Kristal malzeme bir tetramerdir, yani [SbF4(μ-F)]4 formülüne sahiptir. Sb-F bağları, sekiz üyeli Sb4F4 halkası içinde 2,02 Å; dört Sb merkezinden yayılan kalan florür ligandları 1,82 Å'de daha kısadır.[4] PF5 ve AsF5 ilgili türleri, muhtemelen koordinasyon sayılarını sınırlayan merkez atomun daha küçük boyutları nedeniyle katı ve sıvı hallerde monomeriktir. BiF5 bir polimerdir.[5]
SbF5 in HF'nin Brønsted asitliğini arttırdığı gibi, F2 nin oksitleyici gücünü de arttırır. Bu etki, oksijenin oksidasyonu ile gösterilmektedir:
- 2 SbF5 + F2 + 2 O2 → 2 [O2]+[SbF6]−
Antimon pentaflorür, florür bileşiklerinden flor gazı üreten ilk keşfedilen kimyasal reaksiyonda da kullanılmıştır:
- 4 SbF5 + 2 K2MnF6 → 4 KSbF6 + 2 MnF3 + F2
Bu reaksiyonun itici gücü, SbF5 in F-'ye, olan yüksek afinitesidir; bu, SbF5'in süper asitler oluşturmak için kullanılmasını öneren aynı özelliktir.
Hekzafloroantimonat
değiştirSbF5, hekzafloroantimonat olarak adlandırılan çok kararlı [SbF6]− anyonunu vermek için F− kaynaklarına karşı istisnai olarak güçlü bir Lewis asididir. [SbF6]−, PF6−'ye benzer zayıf koordine edici bir anyondur. Sadece zayıf temel olmasına rağmen, [SbF6]−, merkez simetrik bir eklenti vermek için ek SbF5 ile reaksiyona girer:
- SbF5 + [SbF6]− → [Sb2F11]−
Güvenlik
değiştirSbF5 birçok bileşikle şiddetli reaksiyona girerek genellikle tehlikeli hidrojen florür salar. Cilt ve gözler için oldukça aşındırıcıdır. Güçlü bir oksitleyicidir.[6][7]
Kaynakça
değiştir- ^ a b NIOSH Pocket Guide to Chemical Hazards. "#0036". National Institute for Occupational Safety and Health (NIOSH).
- ^ "World of Chemicals SDS". 18 Ağustos 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Şubat 2023.
- ^ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a03_055.pub2
- ^ Edwards, A. J.; Taylor, P. "Crystal structure of Antimony Pentafluoride" Journal of the Chemical Society, Chemical Communications 1971, pp. 1376-7.DOI:10.1039/C29710001376
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. 0-12-352651-5
- ^ International Programme on Chemical Safety (2005). "Antimony pentafluoride". Commission of the European Communities (CEC). 18 Ağustos 2002 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mayıs 2010.
- ^ Barbalace, Kenneth (2006). "Chemical Database - Antimony Pentafluoride". Environmental Chemistry. Erişim tarihi: 10 Mayıs 2010.
Dış bağlantılar
değiştir- WebBook page for SbF5 3 Şubat 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- National Pollutant Inventory - Antimony and compounds fact sheet 31 Temmuz 2022 tarihinde Wayback Machine sitesinde arşivlendi.
- National Pollutant Inventory - Fluoride compounds fact sheet 3 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi.
