Trioksidan
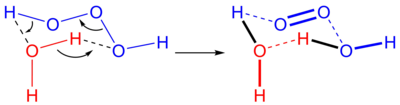
Trioksidan, hidrojen trioksit veya dihidrojen trioksit olarak da adlandırılan, H[O]3H (H2O3 olarak da yazılır) kimyasal formülüne sahip bir inorganik bileşiktir. Kararsız hidrojen polioksitlerdendir.[1] Sulu çözeltilerde, trioksidan su ve tekli oksijen oluşturmak için ayrışır:

| |

| |
Diğer adlar Dihidrojen trioksit Hidrojen trioksit Dihidroksi eter | |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| 200290 | |
PubChem CID
|
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| Özellikler | |
| Molekül formülü | H2O3 |
| Molekül kütlesi | 50.013 g·mol−1 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Ters reaksiyon, suya tekli oksijen ilavesi, tipik olarak kısmen tekli oksijen kıtlığı nedeniyle meydana gelmez. Bununla birlikte biyolojik sistemlerde, ozonun tekli oksijenden üretildiği bilinmektedir ve varsayılan mekanizmanın tekli oksijenden antikorla katalize edilmiş bir trioksidan üretimi olduğu bilinmektedir.[2]
Üretim
değiştirTrioksidan, ozon ve hidrojen peroksit reaksiyonlarında az miktarda, ancak saptanabilir miktarlarda veya suyun elektrolizi ile elde edilebilir. Antrakinon işlemi gibi çeşitli organik çözücülerde ozonun organik indirgeyici maddelerle düşük sıcaklıklarda reaksiyonu yoluyla daha büyük miktarlarda hazırlanır ve ayrıca organik hidrotrioksitlerin (ROOOH) ayrışması sırasında oluşur.[3] Alternatif olarak trioksidan, düşük sıcaklıkta ozonun 1,2-difenilhidrazin ile indirgenmesi suretiyle hazırlanabilir. İkincisinin reçineye bağlı bir versiyonunu kullanarak, nispeten saf trioksidan organik çözücü içinde bir çözelti olarak izole edilebilir. Metitioksorhenyum(VII) katalizörü kullanılarak yüksek saflıkta çözeltilerin hazırlanması mümkündür.[4] –20 °C'de aseton-d6'da, trioksidanın karakteristik 1H NMR sinyali, 13.1 ppm'lik bir kimyasal kaymada gözlenebilir.[3] Dietil eter içindeki hidrojen trioksit çözeltileri -20 °C'de bir hafta kadar güvenle saklanabilir.[4]
Ozonun hidrojen peroksit ile reaksiyonu "perokson işlemi" olarak bilinir. Bu karışım bir süredir organik bileşiklerle kontamine olmuş yeraltı sularının arıtılmasında kullanılmaktadır. Reaksiyon H2O3 ve H2O5 üretir.[5]
Yapı
değiştir2005 yılında trioksidan süpersonik bir jet içinde mikrodalga spektroskopisi ile deneysel olarak gözlemlenmiştir. Molekül, 81.8 ° 'lik bir oksijen-oksijen-oksijen-hidrojen dihedral açısı ile çarpık bir yapıda bulunur. 142.8 pikometrenin oksijen-oksijen bağı uzunlukları, hidrojen peroksit içindeki 146.4 pm oksijen-oksijen bağlarından biraz daha kısadır. Çeşitli dimerik ve trimerik formlar da var gibi görünmektedir. Hidrojen peroksitten biraz daha asidiktir, H+ ve OOOH−'ya ayrışır.[6]
Reaksiyonlar
değiştirTrioksidan, su ve tekli oksijene kolayca ayrışır, oda sıcaklığında organik çözücülerde yaklaşık 16 dakikalık bir yarı ömürle, ancak suda sadece milisaniyeler içinde ayrışır. Sülfoksitler oluşturmak için organik sülfitler ile reaksiyona girer, ancak reaktivitesi hakkında çok az şey bilinir.
Son araştırmalar, trioksidanın iyi bilinen ozon/hidrojen peroksit karışımının antimikrobiyal özelliklerinden sorumlu aktif bileşen olduğunu bulmuştur. Bu iki bileşik biyolojik sistemlerde de mevcut olduğundan, insan vücudundaki bir antikorun, istilacı bakterilere karşı güçlü bir oksidant olarak trioksidan üretebileceği iddia edilmektedir.[2][7] Biyolojik sistemlerde bileşiğin kaynağı, tekli oksijen ve su arasındaki (tabii ki konsantrasyonlara göre her iki yönde ilerleyen), tekli oksijen bağışıklık hücreleri tarafından üretilir.[3][8]
Hesaplamalı kimya, daha fazla oksijen zinciri molekülünün veya hidrojen polioksitlerinin bulunduğunu ve düşük sıcaklıklı bir gazda süresiz olarak uzun oksijen zincirlerinin var olabileceğini öngörmektedir. Bu spektroskopik kanıtla, bu tip moleküllerin araştırması yıldızlararası uzayda başlayabilir.[6]
İnsan kanının pH'sinin 7,4 civarında dengelenmesini H2CO3 Tampon çözeltisi sağlar[kaynak belirtilmeli]
Kaynakça
değiştir- ^ Cerkovnik, Janez; Plesničar, Božo (2013). "Recent Advances in the Chemistry of Hydrogen Trioxide (HOOOH)". Chemical Reviews. 113 (10): 7930–7951. doi:10.1021/cr300512s. PMID 23808683 28 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b Paul T. Nyffeler; Boyle; Eltepu; Wong; Eschenmoser; Lerner; Wentworth Jr (2004). "Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone". Angewandte Chemie International Edition. 43 (35): 4656–4659. doi:10.1002/anie.200460457. PMID 15317003 28 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b c Plesničar, Božo (2005). "Progress in the Chemistry of Dihydrogen Trioxide (HOOOH) 8 Temmuz 2018 tarihinde Wayback Machine sitesinde arşivlendi." (PDF). Acta Chimica Slovenica. 52: 1–12.
- ^ a b Strle, G.; Cerkovnik, J. (2015), "A Simple and Efficient Preparation of High‐Purity Hydrogen Trioxide (HOOOH)", Angew. Chem. Int. Ed., 54 (34): 9917–9920, doi:10.1002/anie.201504084, PMID 26234421 28 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Xu, X.; Goddard, W. A. (2002). "Nonlinear partial differential equations and applications: Peroxone chemistry: Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2". Proceedings of the National Academy of Sciences. 99 (24): 15308–12. Bibcode:2002PNAS...9915308X. doi:10.1073/pnas.202596799. PMC 137712. PMID 12438699 28 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b Kohsuke Suma; Yoshihiro Sumiyoshi & Yasuki Endo (2005). "The Rotational Spectrum and Structure of HOOOH". J. Am. Chem. Soc. 127 (43): 14998–14999. doi:10.1021/ja0556530. PMID 16248618 28 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ A Time-Honored Chemical Reaction Generates an Unexpected Product 14 Kasım 2019 tarihinde Wayback Machine sitesinde arşivlendi., News & Views, September 13, 2004
- ^ Roald Hoffmann (2004). "The Story of O" 12 Ağustos 2019 tarihinde Wayback Machine sitesinde arşivlendi. (PDF). American Scientist. 92: 23. doi:10.1511/2004.1.23.