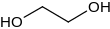
Etilen glikol
Etilen glikol, ya da 1,2-etandiol, (CH2OH)2, bir diol türüdür. Esas olarak iki amaçla, poliester elyaf üretiminde hammadde olarak ve antifriz formülasyonları için kullanılır. Kokusuz, renksiz, viskoz, tatlı tada sahip olup orta düzeyde toksiktir.[1]

| |||
| |||
| Tanımlayıcılar | |||
|---|---|---|---|
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.159 | ||
| EC Numarası |
| ||
| KEGG | |||
| MeSH | Ethylene+glycol | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | C2H6O2 | ||
| Molekül kütlesi | 62,07 g mol−1 | ||
| Görünüm | Renksiz sıvı | ||
| Yoğunluk | 1.1132 g/cm3 | ||
| Erime noktası | −12.9 °C | ||
| Kaynama noktası | 197.3 °C | ||
| Tehlikeler | |||
| NFPA 704 (yangın karosu) |
|||
| Güvenlik bilgi formu (SDS) | External MSDS | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Üretim değiştir
Etilen glikol, etilen oksit yoluyla etilenden (eten) üretilir. Etilen oksit, kimyasal denkleme göre etilen glikol üretmek için su ile reaksiyona girer:
C
2H
4O + H
2O → HO−CH
2CH
2−OH
Bu reaksiyon, asitler veya bazlar tarafından katalize edilebilir veya yüksek sıcaklıklarda nötr pH'ta meydana gelebilir. Etilen glikolün en yüksek verimleri, çok fazla su bulunan asidik veya nötr pH'ta meydana gelir. Bu koşullar altında, %90'lık etilen glikol verimleri elde edilebilir. Yılda yaklaşık 6,7 milyon ton üretilir.[2]
Çoğu kaynağa göre, Fransız kimyager Charles-Adolphe Wurtz (1817-1884) etilen glikolü ilk kez 1856'da hazırladı.[3] Önce etilen iyodürü (C
2H
4I
2) gümüş asetatla işlemden geçirdi ve ardından elde edilen etilen diasetatı potasyum hidroksit ile hidrolize etti. Wurtz yeni bileşiğine "glikol" adını verdi çünkü hem etil alkol (bir hidroksil grubu ile) hem de gliserin (üç hidroksil grubu ile) ile aynı nitelikleri taşıyordu. 1859'da Wurtz, etilen oksidin hidrasyonu yoluyla etilen glikolü hazırladı.[4]
Kullanım alanları değiştir
Antifriz değiştir
Saf etilen glikol yaklaşık -12 °C'de donar, ancak suyla karıştırıldığında karışım daha düşük bir sıcaklıkta donar. Örneğin, %60 etilen glikol ve %40 su karışımı -45 °C'de donar.[2] Dietilen glikol de benzer şekilde davranır. Bazı karışımların donma noktasındaki düşüş, çözeltilerin koligatif özelliği olarak açıklanabilir, ancak örnek gibi yüksek konsantrasyonlu karışımlarda, moleküller arası kuvvetlerin etkisi nedeniyle ideal çözelti davranışından sapmalar beklenir.
Etilen glikol veya propilen glikol olmasına bağlı olarak karışım oranında farklılıklar olabilir. Etilen glikol için karıştırma oranları tipik olarak 30/70 ve 35/65 iken propilen glikol karıştırma oranları tipik olarak 35/65 ve 40/60'tır. Karışımın en düşük çalışma sıcaklığında donmaya dirençli olması önemlidir.[5]
Düşük donma sıcaklıkları nedeniyle, etilen glikol, ön camlar ve uçaklar için buz çözücü bir sıvı olarak, otomobil motorlarında bir antifriz olarak ve biyolojik dokuların ve organların düşük sıcaklıkta korunması için vitrifikasyon (antikristalizasyon) karışımlarının bir bileşeni olarak kullanılır.
Polimer öncülü olarak değiştir
Plastik endüstrisinde etilen glikol, poliester elyaf ve reçinelerin önemli bir öncülüdür. Alkolsüz içecekler için plastik şişe yapımında kullanılan polietilen tereftalat, etilen glikolden hazırlanır.
Diğer alanlarda kullanımları değiştir
Etilen glikolün küçük kullanımları, kişisel bilgisayarlar için sıvı soğutma sistemlerinde ve katot ışını tüpü tipi lens cihazlarının içinde korozyonu önlemek için bir katkı maddesi olarak ve 1,4-dioksan üretiminde kimyasal bir ara madde olarak üretimini içerir. Bazı aşıların üretiminde de etilen glikol kullanılmaktadır, ancak bu enjeksiyonlarda kendisi mevcut değildir. Ayakkabı cilasında ve ayrıca bazı mürekkep ve boyalarda küçük bir bileşen olarak kullanılır. Etilen glikol bazen, hem önleyici hem de sonra için, ahşaplarda bir çürüme ve mantar karşıtı koruma olarak kullanılır.
Etilen glikol, ana bileşen izopropil alkol ile birlikte ekran temizleme solüsyonlarındaki küçük bileşenlerden biri de olabilir. Etilen glikol, formaldehite daha güvenli bir alternatif olarak, özellikle okullarda diseksiyon sırasında biyolojik numuneler için koruyucu olarak yaygın olarak kullanılır. Ayrıca deniz altı petrol ve gaz üretim ekipmanlarını kontrol etmek için kullanılan su bazlı hidrolik sıvının bir parçası olarak kullanılır.
Etilen glikol, ketonlar ve aldehitler gibi karbonil bileşiklerini korumak için organik sentezde bir koruyucu grup olarak kullanılır.[6]
Etilen glikol, doğal gaz endüstrisinde, trietilen glikol (TEG) ile hemen hemen aynı şekilde, daha fazla işlenmeden önce doğal gazdan su buharını çıkarmak için kullanılır.
Toksisite değiştir
Etilen glikol, yutulduğunda memelilerde nispeten yüksek toksisiteyi sahiptir, kabaca metanol ile eşittir ve oral LDLo = insanlar için 786 mg/kg'dır.[7] En büyük tehlike, çocukları ve hayvanları çekebilen tatlı tadından kaynaklanmaktadır. Yutulması sonucunda, etilen glikol glikolik aside oksitlenir ve bu da toksik olan okzalik aside oksitlenir. Bu ve toksik yan ürünleri önce merkezî sinir sistemini, sonra kalbi ve son olarak da böbrekleri etkiler. Yeterli miktarda yutulması, tedavi edilmediği takdirde ölümcüldür.[8]
Etilen glikol yerine neredeyse zehirsiz olan propilen glikol içeren otomotiv kullanımına yönelik antifriz ürünleri mevcuttur. Safsızlıklardan dolayı endüstriyel propilen glikol, etilen glikol kadar tatlı olmadığından ve vücutta metabolizma ve egzersizin normal bir ürünü olan laktik aside dönüştürüldüğünden, genellikle kullanımlarının daha güvenlidir.[9]
Kaynakça değiştir
- ^ Siegfried Rebsdat; Dieter Mayer (2005), "Ethylene Glycol", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a10_10
- ^ a b Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_101.
- ^ Adolphe Wurtz (1856). "Sur le glycol ou alcool diatomique" [On glycol or dibasic alcohol]. Comptes Rendus. 43: 199-204. 6 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mart 2023.
- ^ Ad. Wurtz (1859) "Synthèse du glycol avec l'oxyde d'éthylène et l'eau" 6 Mart 2023 tarihinde Wayback Machine sitesinde arşivlendi. (Synthesis of glycol from ethylene oxide and water), Comptes rendus, 49 : 813–815.
- ^ "Glycol til industri og erhverv" [Glycol for industry and business]. LC Glad (Danca). 19 Şubat 2019 tarihinde kaynağından arşivlendi – lcglad.dk vasıtasıyla.
- ^ "Ethylene glycol acetal". The Organic Synthesis Archive. synarchive.com. 23 Ağustos 2014 tarihinde kaynağından arşivlendi.
- ^ Safety Officer in Physical Chemistry (23 Kasım 2009). "Safety (MSDS) data for ethylene glycol". Oxford University. 17 Mayıs 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Aralık 2009.
- ^ Ethylene glycol 26 Aralık 2017 tarihinde Wayback Machine sitesinde arşivlendi.. National Institute for Occupational Safety and Health. Emergency Response Database. August 22, 2008. Retrieved December 31, 2008.
- ^ Pieter Klapwijk (27 Ocak 2010). "Ethylene Glycol Poisoning". The Rested Dog Inn. 9 Şubat 2004 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Ekim 2012.
Dış bağlantılar değiştir
- WebBook page for C2H6O24 Ekim 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- ATSDR - Case Studies in Environmental Medicine: Ethylene Glycol and Propylene Glycol Toxicity15 Şubat 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- CDC - NIOSH Pocket Guide to Chemical Hazards19 Aralık 2017 tarihinde Wayback Machine sitesinde arşivlendi.
- Medical information1 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Hairong Yue; Yujun Zhao; Xinbin Ma; Jinlong Gong (2012). "Ethylene glycol: properties, synthesis, and applications". Chemical Society Reviews. 41 (11). ss. 4218-4244. doi:10.1039/C2CS15359A. 21 Kasım 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Ekim 2017.